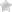- Anonimch
- Перевод изображений: Станислав Кирсанов
- Редакция: Николай Лисицкий, Михаил Гусев, Алексей Дорохов, Deepest Depths
В моей предыдущей статье о фенилэтиламинах я незаслуженно обошёл дофамин вниманием. Безусловно, такой важный гормон заслуживает гораздо более внимательного рассмотрения.Ведь тут как? Человек в области мотивации мало чем отличается от ослика: морковку держат – зверюшка идёт, морковку убрали – не идёт, а пришла зверюшка – так и быть, держи морковку!
Никакой иной системы мотивации для вас эволюция не придумала, увы. Даже великие подвиги, которые свершались якобы ради «великих идей», были лишь попыткой заставить свой мозг дать ещё немного дофамина. Конечно, большинство из нас получает положительное подкрепление способами, мало чем отличающимися от таковых у ослика: секс, еда, секс, еда, доминирование, еда, еда.
У некоторых людей уровень дофамина повышается от совершения весьма специфических действий – создания предметов искусства или, видел таких лично, запаха волос чужих людей.В предыдущей серии я уже упоминал, что связь недостатка уровня дофамина с болезнью Паркинсона была установлена Горникевичем с помощью достаточно простой цветной реакции.
Однако, роль дофамина в качестве нейромедиатора выявил другой учёный – Арвид Карлссон (Нобелевская премия по физиологии и медицине за 2000 год).
До него дофамин считался лишь прекурсором норадреналина, а не сигнальным веществом.
Именно в опытах Карлссона с резерпином, о которых также упоминалось в предыдущей статье, и была установлена прямая связь между уровнем дофамина и двигательными функциями.
С развитием биохимии и молекулярной биологии появилась возможность детальнее изучить функции этого нейромедиатора.
Начиная от его роли в координации движений и заканчивая объяснением действия некоторых антипсихотиков и психостимуляторов.
Также многие исследователи рассматривают нарушения обмена этого нейромедиатора в качестве одной из причин шизофрении, т.е. существует «дофаминовая теория шизофрении».
ММетаболизм дофамина
Синтез дофамина и остальных катехоламинов Как и у многих других катехоламинов, его путь начинается с фенилаланина и L-тирозина, которые гидроксилируются (фенилаланин по 3 и 4 положениям, тирозин – только по 3), таким образом, превращаясь в 3,4-дигидроксифенилаланин (он же – ДОФА). ДОФА в свою очередь декарбоксилируется ДОФА-декарбоксилазой и превращается в дофамин.
Небольшое отступление — от названия своего прекурсора дофамин и получил такое название – ДигидрОксиФенэтилАмин. ДоПамин является неправильным, пусть и распространённым, написанием (возникшим в результате буквального переписывания англоязычной литературы).
Дальнейший метаболизм дофамина может пойти двумя основными путями:
- Превращение в норадреналин и адреналин;
- Расщепление.
И если стадии синтеза норадреналина и адреналина уже рассматривались ранее, то на катаболизме дофамина следует подробнее остановиться.
В основном дофамин дезаминируется МАО до 3,4-дигидроксифенилацетальдегида (DOPAL), который с помощью альдегиддегидрогеназы (ALDH) и катехол-О-метилтрансферазы превращается в гомованилиновую кислоту (HVA), являющуюся конечным продуктом основного пути распада дофамина. Однако, существует и альтернативный путь – превращение DOPAL в DOPET (3,4-дигидроксифенилэтанол) и затем в MHPE (3-метокси-4-гидроксифенилэтанол).
Здесь конечным метаболитом является именно MHPE. Его роль в организме не до конца выяснена, однако замечено, что его уровни повышаются при приёме дисульфирама, который выступает в качестве блокатора различных форм альдегиддегидрогеназы (ALDH).
РРецепторы дофамина и история их открытия
Изначально локализация дофаминергических структур была выявлена в мозге путём окрашивания различных срезов мозга по методам Falck-Hillarp: гистохимический метод, заключающийся в появлении флуоресценции у дофамина и норадреналина при их взаимодействии с формальдегидом и последующим их превращением в соответствующие изохинолины.
Дофамин в нейронах, окраска по Falck-Hillarp И Fink-Heimer : тоже гистохимический метод, который заключается во введении экспериментальному животному 6-OHDA (6-гидроксидофамин – нейротоксин, накапливающийся благодаря DAT, дофаминовому транспортёру, исключительно в дофаминергических нейронах) и последующим выявлением с помощью серебра нейронов, уничтоженных 6-OHDA за 24 часа.
Такие методики окрашивания имели мало общего с опытами Горникевича, так как позволяли выявить не только собственно наличие дофамина, но локализацию отдельных нейронов, его содержащих.
Опыты на мышах, с прямым введением дофамина в различные части мозга и снятием показаний микроэлектродами, выявили интересный эффект в хвостатом ядре – одна часть нейронов дофамином возбуждалась, другая наоборот тормозилась.
Эти опыты, проведённые Кулсом и Ван Россумом, также выявили различия тормозящих и возбуждающих дофаминовых рецепторов в чувствительности к галоперидолу, эргометрину и апоморфину.
В своей публикации они ввели первую классификацию дофаминовых рецепторов – DAi (тормозящие) и DAe (возбуждающие).
В настоящее время дофаминовые рецепторы, благодаря детальному изучению их структуры и генов, ответственных за их разнообразие, разделены на пять типов.
Однако, основное деление на возбуждающие и тормозящие всё ещё имеет место. Возбуждающие – D1, D5. Вместе они составляют группу D1-подобных. Тормозящие – D2, D3, D4, общее название группы – D2-подобные.
Все дофаминовые рецепторы являются метаботропными, влияющими на уровень цАМФ в нейроне.
Интересной особенностью дофаминовых рецепторов также является наличие большого числа изоформ, возникающих в результате альтернативного сплайсинга и посттрансляционной модификации.
ВВозбуждающие дофаминовые рецепторы
Дофаминовые рецепторы 1 типа Они расположены преимущественно в хвостатом ядре полосатого тела, прилежащем ядре и обонятельном бугорке.
Несмотря на то, что они являются исторически первыми выделенными рецепторами, их функции достаточно сложны и разнообразны.
Веселья добавляет тот факт, что D1-рецептор способен к, казалось бы, парадоксальной гетеромеризации с тормозящими D2,3-рецепторами, мю-опиоидными и Н3-гистаминовыми рецепторами.
Механизм их работы таков: активация аденилатциклазы ведёт к повышению уровня цАМФ, который в свою очередь запускает работу протеинкиназы А.
Она, в свою очередь, может либо выполнить фосфорилирование DARPP-32, которая выступает положительным модулятором NMDA-зависимого пути фосфорилирования CREB, либо переместиться в ядро клетки и напрямую активировать CREB (цАМФ-зависимый транскрипционный фактор).
CREB запускает экспрессию различных генов: BDNF, тирозингидроксилаза, c-fos, Arc, соматостатин, энкефалин, VGF, КРГ.
Источник: журнал Nature. Direct and indirect pathways of basal ganglia: a critical reappraisal
Paolo Calabresi, Barbara Picconi, Alessandro Tozzi, Veronica Ghiglieri & Massimiliano Di Filippo
Nature Neuroscience 17, 1022–1030 (2014) doi:10.1038/nn.3743
Из огромного перечня гормональных процессов, запускаемых активацией D1-рецептора, стоит выделить запуск экспрессии c-Fos. Этот белок связывают с возникновением долговременных адаптивных изменений в ЦНС, а именно – в формировании реакций подкрепления. Например, его уровень повышается в андроген-чувствительных нейронах млекопитающих после совершения полового акта.
Наиболее ярко это выражается в примере с наркотической зависимостью – в этом случае также наблюдается повышенная экспрессия c-Fos в нейронах мезолимбического пути.
В этом смысле нейроны, на которых присутствуют дофаминовые рецепторы, являются «конечной станцией» пути передачи нервного сигнала классическими низкомолекулярными нейромедиаторами, т.к.
при активации D-рецепторов не запускается дальнейшего их высвобождения в межсинаптическое пространство, а происходит «медленный» синтез регуляторных пептидов.
Исключение составляют почки, в клетках которых дофаминовые рецепторы регулируют проницаемость мембран для ионов натрия.
Показано, что хронический стресс уменьшает плотность D1-рецепторов, что в свою очередь может негативно влиять на эмоциональный фон и когнитивные способности за счёт снижения экспрессии нейропластических факторов, напр. BDNF.
В настоящее время выявлен полиморфизм rs686, имеющий статистически значимую корреляцию с риском развития табачной и алкогольной зависимости, однако его вклад в развитие психических заболеваний пока под вопросом.
Лишь полиморфизм rs4532 прочно ассоциирован с шизофренией. Несмотря на большое влияние механизмов, запускаемых активацией D1-рецептора, у мышей, лишённых гена данного рецептора, не выявлено серьёзных анатомических отличий мозга от нормы.
Однако, у них наблюдался низкий уровень энкефалина и нарушенная координация движений. Дофаминовые рецепторы 5 типа Исторически дофаминовые рецепторы нумеровали не по функциям, а по времени открытия.
Конкретно этот тип был открыт лишь пятым, и это связано с тем, что его (на функциональном уровне) практически невозможно отличить от первого.
Некоторые авторы пишут следующее – «Несмотря на то, что роль многих дофаминовых рецепторов уже изучена, функции D5-рецепторов в базальных ганглиях ещё предстоит выяснить. Более того, зачастую очень сложно отличить D1 от D5-рецепторов, поскольку они возбуждаются одними и теми же лигандами, у них принципиально одинаковая структура и действие».
Тут стоит добавить, что одним из важных различий между D1 и D5-рецепторами является собственно чувствительность к дофамину в нормальных условиях – у D5 она в 10 раз выше.
Данный рецептор обнаруживается в миндалевидном теле, префронтальной зоне коры, гиппокампе, полосатом теле, таламусе, гипоталамусе, базальных ядрах переднего мозга, мозжечке, среднем мозге и на вставочных нейронах неостриатума.
Также он присутствует в клетках почек, на дендритных клетках и Т-хелперах. Тут стоит остановиться, чтобы рассмотреть функции D5-рецепторов в почках чуть-чуть подробнее. Данные рецепторы регулируют процесс реабсорбции ионов натрия из проксимальных канальцев.
Происходит это по следующему механизму: запускаемые при активации D5-рецептора процессы фосфорилирования затрагивают такие транспортеры как NHE1, NHE3, Na+/Pi, Na+/HCO3−, Cl−/HCO3− (SLC26A6), и Na+/K+-АТФазу, что вызывает интернализацию данных белков или же прерывание их работы по иному механизму.
Источник: https://cmtscience.ru/article/dophamin-to-radi-chego-ya-vstauy-utrom-s-posteli
Дофамин (стр. 1 из 2)
и дофаминергические препараты
Дофамин – биогенный амин, образующийся из L-тирозина. Он является предшественником норадреналина. Как нейромедиатор он играет важную роль в деятельности центральной и периферической нервной системы.
С влиянием на дофаминергические процессы мозга связан механизм действия ряда нейротропных, в том числе психотропных, препаратов (типа Средства для лечения паркинсонизма, Психотропные препараты, Апоморфин).
Идентифицированы разные подтипы дофаминовых рецепторов: Дь Д2 (возможно, и другие – до Д5
-рецепторов)1
.
Через Д1 – рецепторы опосредовано стимулирующее действие дофамина на активность аденилатциклазы и на образование циклического АМФ; Д2-рецепторы с этим эффектами не связаны. Некоторые фармакологические вещества являются в той или иной мере селективными агонистами разных Д-рецепторов.
Дофамин является в большей мере агонистом Дг-рецепторов (в больших концентрациях он является также агонистом Д1-рецепторов). В последнее время получены селективные агонисты Д2
-рецепторов в ряду производных алкалоидов спорыньи.
- Антагонистами Д2~рецепторов являются ряд нейролептиков,
а также метоклопрамид
и домперидон. - Предложены также для применения в медицинской практике некоторые другие препараты, влияющие на дофаминергические процессы.
- 1. ДОФАМИН (
Dophaminum
,
Dofaminum
) - 2 – (3,4 – Диоксифенил) – этиламин, или окситирамин:
СИНОНИМЫ: Допамин, Допмин, Aprical, Cardiosteril, Dopamex, Dopamine
,
Dophan, Dopmin, Dynatra, Hydroxy-tyramin, Intropin, Revivan.
Для применения в качестве лекарственного средства дофамин получают синтетическим путем.
По химической структуре дофамин является катехоламином и обладает рядом фармакологических свойств, характерных для адренергических веществ.
Он оказывает специфическое влияние на дофаминовые рецепторы, для которых является эндогенным лигандом, однако в больших дозах он стимулирует также α- и β-адренорецепторы.
Влияние на адренорецепторы связано со способностью дофамина высвобождать норадреналин из гранулярных (пресинаптических) депо, т.е. оказывать непрямое адреномиметическое действие.
Под влиянием дофамина происходит увеличение сопротивления периферических сосудов (менее сильное, чем под влиянием норадреналина) и повышение систолического артериального давления (результат стимуляции α-адренорецепторов); усиливаются сердечные сокращения (результат стимуляции β-адренорецепторов), увеличивается сердечный выброс. Частота сердечных сокращений меняется относительно мало. Потребность миокарда в кислороде повышается, однако в результате увеличения коронарного кровотока обеспечивается повышенная доставка кислорода.
Вследствие специфического связывания с дофаминовыми рецепторами почек дофамин уменьшает сопротивление почечных сосудов, увеличивает в них кровоток и почечную фильтрацию. Наряду с этим повышается натрийурез; происходит также расширение мезентериальных сосудов.
Этим действием на почечные и мезентериальные сосуды дофамин отличается от других катехоламинов (норадреналина, адреналина и др.). Однако в больших дозах (при введении людям в дозах, превышающих 15 мкг/кг в минуту) дофамин может вызывать сужение почечных сосудов.
Дофамин ингибирует также синтез альдостерона.
Фармакологические эффекты дофамина проявляются при его внутривенном введении; при введении в желудок он плохо всасывается. В связи с тем, что он быстро разлагается, основным способом его применения является медленная капельная инфузия.
Через гематоэнцефалический барьер дофамин не проникает и при введении в вену не оказывает влияния на ЦНС (см. Средства для лечения паркинсонизма).
Показаниями к применению дофамина являются шоковые состояния различной этиологии: кардиогенный, травматический, эндотоксический, послеоперационный, гиповолемический шок и др.
В связи с меньшим влиянием на периферическое сосудистое сопротивление, увеличением почечного кровотока и кровотока в других внутренних органах, меньшим хронотропным эффектом и другими особенностями дофамин считают в этих случаях более показанным, чем норадреналин и другие катехоламины.
Применяют также дофамин для улучшения гемодинамики при острой сердечной и сосудистой недостаточности, развивающейся при различных патологических состояниях.
Вводят дофамин внутривенно капельно; 25 или 200 мг (0,5% или 4% раствор) препарата разводят соответственно в 125 или 400 мл 5% раствора глюкозы или изотонического раствора натрия хлорида4 (содержание дофамина в 1 мл составляет соответственно 200 или 500 мкг).
Начальная скорость введения составляет 1–5 мкг/кг в минуту (2–10 капель 0,05% раствора). При необходимости скорость введения увеличивают до 10–25 мкг/кг в минуту (в среднем 18 мкг/кг в минуту). Инфузию производят непрерывно в течение от 2–3 ч до 1–4 дней. Суточная доза достигает 400–800 мг.
Действие препарата наступает быстро и прекращается через 5–10 мин после окончания введения.
Оптимальную дозу необходимо в каждом отдельном случае подбирать под постоянным контролем гемодинамики и ЭКГ.
Необходимо учитывать, что превышение оптимальных доз дофамина может привести к значительному возрастанию работы сердца, что может усилить локальную и общую ишемию и отрицательно сказаться на функциональном состоянии ишемизированного миокарда.
Большие дозы дофамина могут вызвать тахикардию и аритмии, почечную вазоконстрикцию. Уменьшение диуреза без гипотензии указывает на необходимость снижения дозы. При развитии аритмий целесообразно применение антиаритмических средств (ли-докаина и др.).
- При гиповолемическом шоке следует сочетать применение дофамина с введением плазмы или плазмозаме-щающих препаратов (или крови).
- ФОРМА ВЫПУСКА: 0,5% или 4% раствор в ампулах по 5 мл (25 или 200 мг).
- ХРАНЕНИЕ: СПИСОК Б.
- 2. ИБОПАМИН (
Ibopamine
) - 4 – [2 – (Метиламино) этил] – 0-фенилендиизобутират:
СИНОНИМЫ: Эскандин, Escandin. По структуре и фармакологическим свойствам близок к дофамину. Эффективен при приеме внутрь.
- Применяется как кардиотоническое средство при хронической сердечной недостаточности.
- Принимают (за 1 ч до еды) в дозе 0,05–0,2 г 2–3 раза в день.
- Возможные побочные явления: тошнота, диспепсия, тахикардия, гипергликемия (при больших дозах).
Противопоказания: желудочковые аритмии, феохромоцитома, беременность, кормление грудью. Не рекомендуется одновременное применение с амиодароном (кордароном).
ФОРМА ВЫПУСКА: таблетки по 0,05 и 0,1 г.
Примечание. Препарат относительно новый (вошел в медицинскую практику в 1980-х годах), нуждается в дальнейшем накоплении опыта применения. Нет достаточного опыта применения у детей.
3. БРОМОКРИПТИН (
Bromocriptine
)*.
2-Бром-а-эргокриптин:
- Выпускается в виде мезилата (метансульфоната).
- СИНОНИМЫ: Абергин, Бромкриптин, Бромэргон, Лактодел, Парлодел,
Серокриптин, Abergin, Bromergon, Bromocriptinummesilat, Lactodel, Parlodel, Pravidel, Sero-criptine. - Бромокриптин – полусинтетическое производное алкалоида спорыньи – эргокриптина.
- Является специфическим агонистом дофаминовых рецепторов (главным образом типа Д2
). - Препарат активно влияет на кругооборот дофамина и норадреналина в ЦНС, уменьшает выделение серотонина.
В связи со стимулирующим действием на дофаминовые рецепторы гипоталамуса бромокриптин оказывает характерное тормозящее влияние на секрецию гормонов передней доли гипофиза, особенно пролак-тина и соматотропина. Эндогенный дофамин является физиологическим ингибитором секреции этих гормонов.
Синтеза пролактина бромокриптин не нарушает. Тормозящее влияние на секрецию гормона снимается блокаторами дофаминовых рецепторов (например, аминазином).
Бромокриптин (как и апоморфин, являющийся стимулятором Дг-рецепторов) оказывает рвотное действие, снижает температуру тела, уменьшает акинезию, вызванную резерпином, тетрабеназином, фенотиазиновы-ми нейролептиками. Препарат оказывает гипотензивное действие, связанное с влиянием на ЦНС, симпатические нервные окончания и гладкую мускулатуру сосудов. Снижает содержание в крови катехоламинов.
В отличие от эргометрина, метилэргометрина и других аналогичных препаратов спорыньи (см.) он не оказывает «маточного» (окситоцического) действия. Наоборот, он угнетает сокращения матки, вызванные метилэргометрином.
Препарат всасывается быстро. Пик концентрации в плазме крови наблюдается через 2–3 ч после приема внутрь. Выделяется в основном с калом, в небольших количествах с мочой.
Бромокриптин нашел применение в акушерской и гинекологической практике.
В акушерстве препарат применяют для подавления послеродовой лактации, когда она противопоказана (тяжелые заболевания матери, преждевременное родоразрешение, гибель новорожденного и др.).
Применение препарата предупреждает лактацию, нагрубание молочных желез и развитие лактационного мастита, восстанавливает функцию яичников.
Назначают препарат внутрь (во время еды) по 0,0025 мг (1 таблетка) 2 раза в день в течение 10–17 дней. При необходимости лечение может быть продолжено. Преждевременная отмена препарата может привести к возобновлению лактации.
Наряду с прекращением лактации, бромокриптин вызывает восстановление менструального цикла и способствует наступлению беременности у женщин с гиперпролактиновой аменореей.
В гинекологической практикехфи синдроме галактореи – аменореи, развившемся после родов, при нарушении функции яичников и бесплодии, обусловленных гиперпролактинемией, и при других заболеваниях назначают по 0,00125 г. (1
/2
таблетки) 2–3 раза в день, при необходимости по 0,0025 г. (1 таблетка) 2–4 раза в день. Курс лечения 3–6 мес.
Источник: https://mirznanii.com/a/149790/dofamin
Симптомы болезни Паркинсона появляются вследствие недостатка дофамина в substantia nigra и в corpus striatum
Для болезни Паркинсона характерны тремор, брадикинезия (слабость и ограниченность двигательной активности) и ригидность мышц. Оно редко встречается в возрасте до 40 лет, но в возрасте свыше 50 лет этим заболеванием страдают 1% людей. Понятие паркинсонизм — более широкое. Оно включает и другие заболевания, которые сопровождаются вышеназванными симптомами.
Ключевым патологическим признаком болезни Паркинсона является дегенерация пигментных клеток в substancia nigra.
В норме эти клетки синтезируют и используют дофамин в качестве нейромедиатора, за что и получили свое название — дофаминергические.
Дофаминергические нейроны обнаружены во многих областях головного мозга, включая нигростриатальную, мезолимбическую, мезокортикальную и туберогипофизеальную системы.
На рис.18.11 изображен весь процесс действия дофамина в качестве нейромедиатора. Его, как и в случае ацетилхолина, можно разделить на 6 этапов. Аналогичным образом, но с некоторыми особенностями, действуют другие моноаминовые медиаторы (в частности, адреналин и норадреналин). (1) Дофамин образуется из тирозина с помощью ряда ферментативных реакций.
Ключевой реакцией этого синтеза является та, которую катализирует тирозин гидроксилаза. (2) На следующем этапе происходит депонирование дофамина в синаптические пузырьки. Дофамин направляется к месту этой своей своеобразной упаковки с помощью градиента рН. Градиент создает специальный белок, локализованный в везикулярной мембране.
Он закачивает протоны в пузырек за счет гидролиза АТФ. (3) Высвобождается дофамин из места хранения механизмом экзоцитоза. (4) Затем происходит связывание дофамина с постсинаптическими рецепторами. Для этого медиатор диффузией проходит через синаптическую щель. Различают 5 классов дофаминовых рецепторов.
В результате взаимодействия с ними дофамина активируется или ингибируется аденилатциклаза. Возможно, по крайней мере в одном случае, воздействие на другую сигнальную систему (фосфолипаза С и инозитолтрифосфатный механизм). (5) Затем происходит повторное поступление дофамина в пресинаптическое нервное окончание.
Его обеспечивает специальный переносчик, который использует для своей работы энергию гидролиза АТФ. Он локализован в пресинаптической мембране. Дофамин, подвергшийся обратному поступлению, вновь включается в синаптические пузырьки и используется в качестве медиатора.
(6) Часть дофамина разрушается в синаптической щели или в пресинатической терминали после повторного поступления с помощью моноамин оксидазы B (МАО-В). Этот фермент находится на наружной мембране митохондрий в пресинаптическом нервном окончании, а также присутствует в синаптической щели.
МАО-В отличается от МАО-А своим сродством к различным субстратам и чувствительностью к ингибиторам. Оба фермента могут действовать на дофамин, катализируя его превращение в 3,4-дигидроксифенилацетальдегид (ДОФАЦ). Последний превращается в гомованилиновую кислоту (ГВК) при участии катехол-О-метилтрансферазы (КОМТ).
МАО-В ингибирует депренил, в то время как специфическим ингибитором фермента типа А является клоргилин. На рис.18.11 показаны также точки приложения действия лекарственных препаратов, которые используются для лечения паркинсонизма и те, которые, наоборот, вызывают явления паркинсонизма в качестве своего побочного действия.
Рис. 18.11. Схематическое изображение высвобождения дофамина из нейрона в substantia nigra и мест действия лекарственных препаратов, которые устраняют или вызывают явления паркинсонизма.
6 этапов, описанных в тексте, показаны на схеме, но не пронумерованы. Показаны точки приложения действия лекарственных препаратов (L-ДОФА, депренил, амантадин, агонисты дофаминовых рецепторов [такие как бромокриптин]), используемых для лечения паркинсонизма.
В общем плане, эти препараты локально увеличивают концентрацию дофамина, которая низка при паркинсонизме.
С другой стороны, помечены места действия ряда препаратов (резерпина и антагонистов дофаминовых рецепторов, в частности, нейролептиков), которые вызывают паркинсонизм за счет снижения уровня дофамина и конкуренции с ним за место связывания на рецепторах.
Дегенеративный процесс, приводящий к нарушению вышеописанного механизма, является причиной существенного снижения синтеза дофамина, в результате падает его уровень в substantia nigra и corpus striatum (хвостатое ядро и путамен).
Снижение уровня дофамина приводит к росту в клетках нигростриатальной системы отношения ацетихолин/дофамин, так как концентрация ацетилхолина не подвергается при этом значительным изменениям.
Подобный дисбаланс служит причиной различных двигательных расстройств, наблюдаемых при болезни Паркинсона.
До сих пор непонятно, почему в механизме клеточного повреждения при этой патологии на первом месте находится повреждение дофаминергических клеток в substantia nigra. Отсутствуют доказательства участия генетического компонента при болезни Паркинсона.
Частично, повреждение клеток может быть следствием процесса старения, поскольку, начиная с 25 лет, за каждые последующие 10 лет в substantia nigra исчезает 13% клеток. Установлено, что симптомы болезни Паркинсона появляются тогда, когда уровень дофамина в нигростриатальной системе снижается на 80%.
Паркинсонизм могут вызывать вирусные инфекции, однако в настоящее время это встречается достаточно редко. У шахтеров в результате длительного контакта с высокими концентрациями Mn2+ также может развиваться этот синдром.
Важной причиной паркинсонизма могут быть лекарственные средства (резерпин и нейролептики-антипсихотики), причем после прекращения терапии этими препаратами явления паркинсонизма могут исчезать. Как показано на рис.18.
11, резерпин снижает уровень дофамина, ингибируя процесс его депонирования в пресинаптических нервных окончаниях, а нейролептики блокируют рецепторы к дофамину. В последнее время внимание исследователей привлек 1-метил-4-фенил-1,2,3,6-тетрагидропиридин (МФТП).
Это соединение является причиной острого паркинсонизма у наркоманов, поскольку в качестве побочного продукта оно входит в состав героина. Моноаминоксидаза Б катализирует превращение МФТП в ион 1-метил-4-фенил-пиридина (МФП+), который проявляет высокую нейротоксичность. Его поступление в дофаминергические клетки substantia nigra опосредует система захвата дофамина. Поступая, МФП+ повреждает эти клетки оксидантным механизмом, поскольку является свободным радикалом. Вдобавок, дофамин и сам, окисляясь в клетках, может превращаться в потенциально токсичные радикалы.
Один из подходов в заместительной терапии болезни Паркинсона состоит в том, что L-ДОФА проходит через гематоэнцефалический барьер и превращается в мозге в дофамин
Как только стало известно (в начале 60-х годов), что в нигростриатальной системе снижается уровень дофамина, в лечении болезни Паркинсона началась новая эра. В настоящее время имеются 3 подхода. (1) До установления важности низкого уровня дофамина ведущим направлением была антихолинергическая терапия. Оно все ещё используется для лечения некоторых больных.
(2) Введение предшественников дофамина восстанавливает его уровень до близкого к норме. Сам дофамин не способен проникать через гематоэнцефалический барьер, поэтому сам по себе он не может использоваться при лечении. Препаратом выбора является L-ДОФА (L-3,4-дигидроксифенилаланин).
Он проникает через гематоэнцефалический барьер и в последующем превращается в дофамин с помощью фермента ДОФА декарбоксилазы (другое название — декарбоксилаза ароматических аминокислот, рис.10). Следует отметить, что большая часть поступающего в организм ДОФА подвергается декарбоксилированию в других периферических органах и тканях, и только 1% достигает мозга.
Причем, использование более высоких доз не является решением проблемы, поскольку они вызывают тошноту и рвоту. Выход был найден в совместном введении в организм L-ДОФА и карбидопа, соединения, которое ингибирует активность ДОФА декарбоксилазы в периферических органах и тканях.
При этом оно не проходит через гематоэнцефалический барьер и поэтому не тормозит превращение L-ДОФА в дофамин в мозге. Интересно, что высокобелковая диета является источником аминокислот, которые конкурируют с L-ДОФА при всасывании в клетки кишечника. Низкобелковая диета благоприятствует всасыванию этого соединения.
Применение L-ДОФА стало основным способом лечения больных, страдающих болезнью Паркинсона. Собственно, сама диагностика болезни Паркинсона основана на ответной реакции на введение в организм L-ДОФА. Если после этого наступает улучшение, значит у пациента болезнь Паркинсона.
В значительной части случаев у людей с явлениями паркинсонизма не наблюдается существенного улучшения состояния после введения L-ДОФА. К сожалению, через 5 лет приема благотворное влияние L-ДОФА исчезает, и тогда требуется альтернативная терапия. (3) Введение агонистов дофаминовых рецепторов (бромокриптин), которые оказывают действие, подобное дофамину (рис.18.11).
В лечении болезни Паркинсона полезны и другие лекарственные препараты, которые оказывают влияние на метаболизм дофамина или являются нейропротекторами
Их использование базируется на знании механизмов снижения дофамина и повреждения substantia nigra нейротоксинами.
Антивирусный препарат амантадин усиливает высвобождение дофамина из пресинаптических нервных окончаний дофаминергических клеток и, таким образом, увеличивает его концентрацию на постсинаптической мембране (рис.18.11).
Мазиндол ингибирует поглощение дофамина, опять-таки повышая концентрацию дофамина на постсинаптической мембране. Растет интерес к использованию L-депренила (селегилина). Предварительное введение этого препарата в организм животных препятствует развитию паркинсонизма, вызванного МФТП.
Предполагается, что он оказывает нейропротекторное действие, уменьшая оксидантное повреждение клеток. Депренил ингибирует МАО-Б, снижая разрушение дофамина и, тем самым, увеличивая концентрацию последнего. Испытывается эффективность использования в клинике витамина Е в качестве антиоксиданта.
Ещё один подход заключается в ведении в организм фибробластов с измененным геномом, позволяющим им продуцировать большое количество тирозин гидроксилазы, ключевого фермента в синтезе дофамина.
Не нашли то, что искали? Воспользуйтесь поиском:
Источник: https://studopedia.ru/3_171938_simptomi-bolezni-parkinsona-poyavlyayutsya-vsledstvie-nedostatka-dofamina-v-substantia-nigra-i-v-corpus-striatum.html
Влияние прекурсоров на организм: L-Dopa
Дофамин широко известен как «гормон удовольствия». Когда мы переживаем положительные эмоции, его уровень повышается. И чем ярче и острее наши ощущения, тем больше дофамина мы получим.
На этом и строится человеческая система мотивации – биохимия в чистом виде: все великие подвиги и свершения всегда являются попыткой организма получить еще немного дофамина.
Со временем были открыты и изучены другие функции этого вещества.
В данной статье разберемся, откуда берется, как работает дофамин и его предшественник L-ДОФА в человеческом теле.
Что такое L-ДОФА и когда он был открыт?
L-Диоксифенилаланин (3,4-дигидроксифенилаланин или L-ДОФА, или ДОФА) – это биологически активное соединение, являющееся прямым предшественником дофамина.
Дофамин совмещает важные функции гормона и нейромедиатора. Поэтому в теле обнаружено несколько мест его производства, в зависимости от дальнейшей точки приложения.
Путь биосинтеза дофамина выглядит так: незаменимая аминокислота фенилаланин поступает в организм с пищей, метаболизируется в клетках печени в L-тирозин. Из его молекулы синтезируется L-диоксифенилаланин.
Далее ДОФА специальным переносчиком транспортируется через гематоэнцефалический барьер в мозг, где и превращается в нейромедиатор дофамин. Последующее преобразование идет двумя путями: производство норадреналина и адреналина или расщепление.
В качестве гормона дофамин вырабатывается в эндокринных железах и в ряде остальных тканей: в почках, в амакриновых клетках сетчатки, в поджелудочной железе, в клетках костного мозга и селезенки.
Прекурсор дофамина L-ДОФА обнаружен в семенах многих растений (в порядке от большего содержания к меньшему):
- Мукуна жгучая (это основной источник ДОФА для аминокислотных добавок, выпускаемых фармацевтическими компаниями).
- Холтония, Аттерим, Гигантин (это растения из семейства Мукуны с достаточно высоким содержанием действующего вещества).
- Сесбания беспиноза.
- Тамаринд.
- Акация.
- В традиционной аюрведе экстракт Мукуны применяется в течение более двух тысяч лет для укрепления здоровья мозга.
Открытие уникального вещества и одного из главных гормонов – дофамина, случилось давно.
В качестве химического соединения он был синтезирован впервые в 1910 году, но только через 28 лет ученые обнаружили его роль в цепи производства гормонов норадреналина и адреналина.
В 1950-х годах исследователи обнаружили присутствие дофамина в крови, в нейронах головного мозга и в других тканях тела человека.
Следующий виток в истории открытия функций дофамина стартовал в связи с изучением механизма возникновения и лечения болезни Паркинсона. Австрийский биохимик Олег Горникевич выявил взаимосвязь между низким уровнем гормона дофамина с развитием этого заболевания.
А вот роль дофамина как нейромедиатора установил в 1957 году шведский фармаколог Арвид Карлссон, за что в 2000 году был удостоен Нобелевской премии по физиологии и медицине. До этого открытия дофамин считался только прекурсором норадреналина.
В своих экспериментах ученый нашел связь недостатка дофамина с нарушением двигательных функций. Опытным путем Карлссон показал, что применение L-ДОФА у животных с симптомами болезни Паркинсона уменьшает выраженность клинических проявлений.
Как L-ДОФА влияет на организм?
Главная роль L-ДОФА – быть источником дофамина, поэтому стоит подробно рассмотреть влияние многозадачного дофамина на человеческий организм.
Гормон и нейромедиатор дофамин проявляет свое действие через специфические рецепторы. В настоящее время обнаружено 5 типов дофаминергических рецепторных структур, которые подразделяются на возбуждающие и тормозящие. Интересно, что нумерация рецепторов обозначает последовательность их обнаружения, а не выполняемую роль.
Возбуждающие рецепторы:
- 1 типа: располагаются в головном мозге. Активация этого класса рецепторов служит основой для развития долговременных адаптивных изменений в центральной нервной системе. А это, в свою очередь, является базой для формирования разного рода зависимостей (например, табачной или алкогольной).
- 5 типа: расположены в почках. Основная функция этих рецепторов состоит в регуляции обратного всасывания ионов натрия из крови для поддержания оптимального уровня артериального давления и сосудистого тонуса в организме.
- Тормозящие рецепторы:
- 2 типа: находятся в головном мозге. Отмечена связь дисфункции этих рецепторов с возникновением различных неврологических и психических заболеваний. Самой изученной является взаимосвязь с шизофренией, развитием зависимостей и лекарственной дискинезией.
- 3 типа: расположены в головном мозге. В настоящее время обнаружена связь нарушения функции этих рецепторов и появления шизофрении.
- 4 типа: находятся в центральной нервной системе. Описан необычный эффект при мутации гена, кодирующего данный тип рецепторов: повышенная любопытность и познавательная активность.
- Если обобщить все известные не сегодняшний день сведения о влиянии дофамина, то группы его функций можно описать так:
- Ответственность за реакции вознаграждения и мотивации. При достижении значимых для конкретного человека результатов происходит повышение выброса дофамина в кровь, и мы испытываем положительные эмоции. И наоборот, при отрицательном результате мозг через снижение содержания и выброса дофамина вводит нас в состояние неудовольствия. Гормон служит для формирования реакции подкрепления в случае успеха, благодаря этому и приобретается мотивация для дальнейшей работы.
- Контроль поведения. Гормон отвечает за преобразование инстинктивно возникающих импульсов к действию в конкретные шаги к достижению цели. Другими словами, он регулирует исполнение наших желаний, в том числе сексуального характера. Дофамин помогает нам сделать выбор в стратегии поведения в конкретной ситуации. Эта же система ответственна за формирование патологической зависимости, например, наркомании.
- Контроль двигательных функций. В клинической практике установлено, что постепенная гибель нейронов данной сигнальной цепи приводит к развитию болезни Паркинсона.
- Регуляция уровня содержания других гормонов в организме, в частности – торможение синтеза пролактина.
- Влияние на когнитивные способности. Дофамин улучшает концентрацию, повышает сосредоточенность и память, при этом помогает легче переключать внимание в процессе обдумывания решений.
- Какие эффекты прекурсора дофамина имеют значение в медицинской практике?
- В практической медицине предшественник дофамина используется как лекарственное средство, биологически активен именно L-изомер (существует еще D-форма).
- Так как сам дофамин не способен проникать через гематоэнцефалический барьер, то в состав всех лекарств для повышения уровня гормона в организме входит его прекурсор L-ДОФА.
Самым распространенным показанием к назначению препаратов на основе дигидроксифенилаланина является болезнь Паркинсона. Это неврологическое заболевание сопровождается прогрессивной гибелью нейронов, ответственных за выработку нейромедиатора дофамина. Болезнь проявляет себя постоянно ухудшающейся координацией движений, патологическим изменением мышечного тонуса, появлением непроизвольных движений и тремором конечностей. Полностью вылечить заболевание невозможно, но с помощью препаратов L-ДОФА хорошо купируются симптомы двигательных нарушений или дискинезии.
Согласно одной из существующих теорий, долгосрочное патологическое колебание уровня дофамина в организме может стать причиной шизофрении. Это психиатрическое заболевание связывают с повышенным синтезом дофамина в одних отделах головного мозга и пониженной продукцией в других частях.
Проводились клинические эксперименты, которые показали, что нарушение работы дофаминергической системы служит одной из причин развития шизофрении и других психотических нарушений.
Соответственно, представляет интерес дальнейшее изучение применения агонистов и антагонистов дофамина при этих гиперактивных состояниях.
В отношении влияния на когнитивные способности было выполнено интересное исследование, которое показало, что L-ДОФА усиливает усвоение новых выдуманных слов у людей. Также было отмечено повышение обучаемости в целом.
Один из побочных эффектов применения ДОФА при болезни Паркинсона проложил дорогу изучению применения предшественника дофамина в новом качестве. Стало известно, что прием препарата часто приводит к гиперсексуальности пациентов. Это объясняется чрезмерным насыщением организма дофамином.
Потенциально это может быть использовано в лечении сексуальных расстройств и повышении либидо.
Правда, авторы исследований говорят о том, что изолированный эффект применения препаратов дофамина не обладает достаточной силой воздействия, но может быть полезен в комплексе с другими лекарствами.
Таким образом, функции дофамина в организме очень разнообразны. Это и один из важнейших гормонов, и нейромедиатор, который улучшает настроение и пробуждает интерес к жизни. Поэтому очень большой потенциал представляет изучение предшественника гормона – вещества L-ДОФА для медицинских целей.
Список литературы:
- 1. Порядин Г. В., Северьянова Л. А., Сергеев О. С. Гормональная регуляция основных физиологических функций организма и механизмы ее нарушения. Москва, 2004
- 2. Leite Tavares R., Conceicao Rodrigues Goncalves M., Souza Aquino J., Suelen Brito da Silva R., Sergio Silva A. Androgenic and Anabolic Possibilities of Mucuna Pruriens. Journal of Food and Nutrition Research. 2017
- 3. Feyder, Bonito-Oliva A., Fisone G. L-DOPA-induced dyskinesia and abnormal signaling in striatal medium spiny neurons: focus on dopamine D1 receptor-mediated transmission. Front. Behav. Neurosci. Oct 2011
- 4. Giuliano F, Allard J. Dopamine and sexual function. Eur Urol. Dec 2001
- 5. Chunyu Zeng, Hironobu Sanada, Hidetsuna Watanabe, Gilbert M. Eisner, Robin A. Felder, Pedro A. Jose. Functional genomics of the dopaminergic system in hypertension. Nov 2004
Источник: https://PsychoSearch.ru/practice/veshchestva/508-vliyanie-prekursorov-na-organizm-l-dopa
Дофаминомиметики (агонисты дофаминовых рецепторов, дофаминергические средства)
Безболезненный вазоспазм пальцев – это осложнение длительного лечения, оно обратимо при снижении дозы препаратов. Возможны аритмии (служат причиной отмены препаратов).
Дискинезии (аномальные движения, сходные с таковыми при приеме леводопы) могут вызываться бромокриптином . В этих случаях необходимо снизить дозу препарата.
К осложнениям дофаминергической терапии можно отнести: нарушения сознания, галлюцинации, бред. Они возникают при комбинированной терапии. Исчезают после прерывания лечения. Другими побочными эффектами являются: головная боль, бессонница, легочные инфильтраты, эритромелалгия (покраснение и припухлость ног или рук, иногда с артралгией). Эти симптомы исчезают после отмены препаратов.
Эрголиновые производные ( бромокриптин , перголид , каберголин ) чаще вызывают периферические побочные эффекты (эритромиалгии, легочный и ретроперитонеальный фиброзы, синдром Рейно), чем неэрголиновые производные ( прамипексол , ропинирол, хинаголид ).
- Допамин. Тахикардия, боли за грудиной, повышение АД, тошнота, рвота, головная боль, беспокойство, тремор; при применении высоких доз — аритмии. В очень редких случаях возможны кровотечения из ЖКТ. У больных бронхиальной астмой возможны приступы удушья. При попадании препарата под кожу возможны некрозы кожи, подкожной клетчатки.
- Агонисты дофамина, являющиеся производными алкалоидов спорыньи. Являются агонистами D1- дофаминовых рецепторов. Бромокриптин . Тошнота, рвота, головокружение (возникают обычно на первой неделе лечения); редко запор, сухость во рту, ортостатическая гипотензия. При передозировке — психомоторное возбуждение, сонливость, галлюцинации, кожная сыпь, обратимый спазм периферических сосудов конечностей. Для устранения начального головокружения и тошноты рекомендуется за 1 час до приема препарата принять противорвотное средство. Необходимо контролировать артериальное давление во время лечения. Перголид . Побочное действие: возможны беспокойство, бессонница, спутанность сознания, кошмарные сновидения, галлюцинации, сонливость, депрессия, головокружение, парестезии, дискинезии, тремор; боли различной локализации; ортостатическая гипотензия, аритмии сердца, отеки; тошнота, рвота, диарея, запор; ринит, фарингит, плеврит, плевральный фиброз; частые позывы на мочеиспускание; дисменорея; нарушения зрения, изменение вкуса; изменение массы тела, кожные высыпания, потливость. С осторожностью применяется у пациентов с нарушениями сердечного ритма, а также у больных с указаниями в анамнезе на плеврит, перикардит, ретроперитонеальный фиброз.
- Агонисты дофамина, не являющиеся производными алкалоидов спорыньи. Являются агонистами D2-дофаминовых рецепторов. Прамипексол . Со стороны нервной системы и органов чувств: астения, сонливость/бессонница, галлюцинации, бред, амнезия, спутанность сознания, головокружение, тревожность, депрессия, дисфагия, дистония, акатизия, нарушения мышления, суицидальная настроенность, экстрапирамидный синдром, дискинезия, тремор, гипостезия, гипокинезия, миоклонус, атаксия, нарушение координации движений, диплопия, паралич аккомодации, конъюнктивит, ослабление слуха; в единичных случаях (при быстром уменьшении дозы или резкой отмене) — злокачественный нейролептический синдром (гипертермия, мышечная ригидность, нарушение сознания, вегетативная лабильность). Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): ортостатическая гипотензия, тахикардия, аритмия. Со стороны респираторной системы: одышка, ринит, фарингит, синусит, гриппоподобный синдром, усиление кашля. Со стороны органов ЖКТ: тошнота, рвота, диспепсия, метеоризм, диарея, сухость во рту, анорексия, запор. Со стороны опорно-двигательного аппарата: гипертонус мышц, судороги в мышцах ног, мышечные подергивания, миастения, артрит, бурсит. Прочие: лихорадка; периферические отеки, потливость, повышение внутриглазного давления, понижение либидо, импотенция, уменьшение массы тела; учащение мочеиспускания, инфекции мочевыводящих путей; болевой синдром, в т.ч. боль в грудной клетке, боль в животе, боль в пояснично-крестцовом отделе позвоночника, боль в шее; изменение голоса; повышение активности КФК; аллергические реакции.
- Ингибиторы моноаминооксидазы (МАО). Селегинин. Со стороны пищеварительной системы: снижение аппетита, тошнота, запор или диарея, сухость во рту, дисфагия, повышение активности «печеночных» трансаминаз. Со стороны нервной системы: повышенная утомляемость, головокружение, головная боль, тревога, двигательное и психическое возбуждение, бессонница, галлюцинации, дискинезии; редко – спутанность сознания, психозы. Со стороны сердечно-сосудистой системы: ортостатическая гипотензия, редко – повышение артериального давления, аритмия. Со стороны органов чувств: нарушение остроты зрения, диплопия. Со стороны мочевыделительной системы: задержка мочи, редко – болезненные позывы на мочеиспускание; никтурия. Аллергические реакции: кожная сыпь, одышка, бронхоспазм, фотосенсибилизация. Прочие: иногда – гипогликемия, выпадение волос, повышенное потоотделение.
- Ингибиторы катехол-орто-метилтрансферазы (КОМТ). Толкапон . Бессонница, дискинезии; после резкого снижения дозы или отмены противопаркинсонических препаратов — злокачественный нейролептический синдром (ригидность мышц, повышение температуры, изменения психического состояния); тошнота, анорексия, диарея, повышение активности печеночных трансаминаз. Энтакапон . Тошнота, рвота, запоры или диарея, сухость во рту, боль в животе, гиперкинезы, тремор, головокружение, головная боль, бессонница, необычная утомляемость, галлюцинации, повышенное потоотделение, судороги икроножных мышц, дезориентация, кошмарные сновидения, ортостатическая гипотензия; анемия, снижение уровня гематокрита, эритропения; повышение активности печеночных трансаминаз и КФК. Крайне редко: парадоксальное усиление явлений паркинсонизма, тяжелая дискинезия или злокачественный нейролептический синдром, которые проявляются гипертермией, двигательными нарушениями (ригидность, миоклонус, тремор), изменениями психики и сознания (возбуждение, дезориентация, кома), нарушениями функции вегетативной нервной системы (тахикардия, неустойчивое АД); рабдомиолиз.
- Стимуляторы дофаминергической передачи в ЦНС. Амантадин . Со стороны нервной системы и органов чувств: головокружение, инсомния, тревожность, раздражительность, снижение остроты зрения, возбуждение, тремор, судороги, зрительные галлюцинации. Со стороны сердечно-сосудистой системы и крови (кроветворение, гемостаз): сердечная недостаточность, тахикардия. Со стороны органов ЖКТ: анорексия, тошнота, сухость во рту, диспепсия. Прочие: задержка мочи у больных аденомой предстательной железы, полиурия, никтурия, периферические отеки, дерматоз, появление голубоватой окраски кожи верхних и нижних конечностей. Следует избегать резкой отмены препарата. На фоне лечения противопоказан прием алкоголя. С осторожностью применять во время работы водителям транспортных средств и людям, профессия которых связана с повышенной концентрацией внимания. Мемантин . Со стороны нервной системы и органов чувств: головокружение, внутреннее или двигательное беспокойство, повышенная возбудимость, усталость, повышение внутричерепного давления; тошнота. Пирибедил . Беспокойство, возбуждение; ортостатическая гипотензия; тошнота, рвота, метеоризм.
Источник: https://www.smed.ru/guides/43262
Лекция 13. дофамин и дофаминергические препараты
Фармакология: конспект лекцийВалерия Николаевна Малеванная
Лекция 13. дофамин и дофаминергические препараты
Дофамин – биогенный амин, образующийся из l-тирозина и являющийся предшественником норадреналина и адреналина и медиатором, взаимодействующим с ?– и ?-адренорецепторами, а также со специфическими рецепторами, получившими название дофаминовых и расположенных в различных областях организма.
Много дофаминовых рецепторов в различных областях ЦНС. Их можно разделить на пресинаптические и постсинаптические. Кроме того, постсинаптические дофаминовые рецепторы могут быть разделены на d1, связанные с действием дофамина на активность фермента аденилатциклазы, и d2, не связанные с этим действием.
В зависимости от степени стимуляции дофамином или блокирования нейролептиками этих рецепторов они подразделяются на четыре типа: d1—d4.
Вещества, стимулирующие дофаминовые рецепторы, называются дофаминомиметиками, или агонистами дофаминовых рецепторов, а вещества, блокирующие дофаминовые рецепторы, – дофаминолитиками, или антагонистами дофаминовых рецепторов.
- Дофаминомиметики.
- Эти вещества подразделяются на две группы:
- 1) непрямого действия, влияющие на пресинаптические дофаминовые рецепторы, регулирующие синтез и выделение дофамина и норадреналина;
- 2) прямого действия, влияющие на постсинаптические дофаминовые рецепторы.
- К первой группе непрямого действия из отечественных препаратов относятся леводопа, мидантан и другие, стимулирующие синтез дофамина и предположительно задерживающие его разрушение, способствующие освобождению дофамина из гранул пресинаптических окончаний, применяемые для лечения болезни Паркинсона.
Вторая группа – психостимуляторы, обладающие дофаминергическими свойствами (фенамин (амфетамин)), способствующие освобождению дофамина и норадреналина из гранул пресинаптических нервных окончаний и тормозящие активность МАО и обратный нейрональный захват дофамина. Меридил (метилфенидат) – психостимулятор, обладающий способностью освобождать дофамин из гранул пресинаптических нервных окончаний. Аналогичны им по действию психостимулятор центедрин и другие препараты.
Дофаномиметики прямого действия и дофаноминолитики.
Дофамин (Dofaminum).
Стимулятор прямого действия на дофаминовые рецепторы. Повышает силу сердечных сокращений и уровень артериального давления, увеличивает сердечный выброс, уменьшает сопротивление почечных сосудов, увеличивая в них кровоток, а также диурез.
Применение: шок различной этиологии, острая сердечнососудистая и почечная недостаточность, кардиохирургические операции.
Способ применения: вводят в/в капельно, предварительно растворив в 5 %-ном растворе глюкозы или 0,9 %-ном растворе натрия хлорида (в 1 мл должно быть 500 мкг дофамина). Инфузии проводят непрерывно – от 2–3 ч до 1–4 суток под мониторным наблюдением. Суточная доза в среднем – 800 мкг.
Побочные действия: спазм периферических сосудов, тахикардия, желудочковая экстрасистолия, нарушение дыхания, головная боль, возбуждение.
Противопоказания: феохромоацитома, ингибиторы моноаминооксидазы, средства для наркоза.
Форма выпуска: ампулы по 5 мл 0,5 %-ного раствора № 10. Список Б.
Следующая глава
54-я ЛЕКЦИЯ
Препараты Ртути (Mercurius) Сегодняшнюю лекцию мы посвятим изучению Ртути и ее соединений. Ртуть уже давно известна, и употребляется как лекарство старой медицинской школой. Злоупотребление этим средством, при применении ее в чрезмерном количестве или в
56-я ЛЕКЦИЯ
Препараты Серебра
ЛЕКЦИЯ № 6. Психотропные препараты 1. Психотропные препараты. Нейролептики
Лекарственные средства, избирательно влияющие на сложные психические функции человека, регулирующие его эмоциональное состояние, мотивацию, поведение и психомоторную активность, относят к
ЛЕКЦИЯ № 8. Противосудорожные препараты 1. Противосудорожные (противоэпилептические) средства
Это лекарственные препараты, предупреждающие или прекращающие развитие судорог разного генеза и разной степени выраженности. В группу противосудорожных средств входят и
ЛЕКЦИЯ № 9. Анальгезирующие средства и нестероидные противовоспалительные препараты. Оксинамы и препараты золота 1. Анальгезирующие средства. Наркотические анальгетики
Анальгезирующие средства – это лекарственные препараты, избирательно устраняющие болевую
ЛЕКЦИЯ № 10. Ненаркотические противокашлевые препараты. Рвотные и противорвотные препараты 1. Ненаркотические противокашлевые препараты
К этой группе относят лекарственные средства, лишенные побочных явлений, присущих опиоидам.Различают препараты с центральным
1. Дофамин
Дофамин – биогенный амин, образующийся из l-тирозина и являющийся предшественником норадреналина и адреналина и медиатором, взаимодействующим с ?– и ?-адренорецепторами, а также со специфическими рецепторами, получившими название дофаминовых и расположенных
2. Дофаминергические препараты
Парлодел (Parlodelum).Синоним: Bromocriptinum. Активизирует дофаминовые рецепторы, подавляет секрецию гормона передней доли гипофиза пролактина, не влияя на другие гормоны гипофиза. Уменьшает содержание гормона роста в крови, снижает секрецию АКТГ,
ЛЕКЦИЯ № 14. Гистамин и антигистаминные препараты 1. Гистамин. Гистаминомиметики
Гистамин является одним из медиаторов, участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний. Обычно гистамин находится
ЛЕКЦИЯ № 21. Препараты, улучшающие мозговое кровообращение 1. Препараты, улучшающие метаболические процессы мозга
Препараты, положительно влияющие на кровоснабжение мозга, повышающие обеспечение его кислородом и усиливающие в нем метаболические процессы, а также
39. Дофамин
Дофамин – биогенный амин, образующийся из l-тирозина и являющийся предшественником но-радреналина и адреналина и медиатором, взаимодействующим с а– и b-адренорецепторами, а также со специфическими рецепторами, получившими название дофаминовых и
Дофамин
Является предшественником адреналина. Изменения – см. «Адреналин».Особенности сдачи анализа: исследуется обычно в моче, мочу собирают в течение 24 часов.Норма:• в сыворотке крови – менее 30–40 нг /л;• в моче:дети до 1 года – менее 180 мкг/сут,дети 1–2 года – менее
Дофамин
Когда человек получает некий позитивный опыт (а удовлетворение потребностей — опыт, безусловно, позитивный) — ест или продолжает род (занимается сексом), успешно учится или работает, плавает в море или танцует, — в его мозгу в больших количествах вырабатывается
Так при чем же здесь Дофамин?
Почему же люди принимают наркотики, если они представляют такую смертельную опасность – из-за них можно заработать неприятности с полицией, разрушить свою карьеру и даже умереть раньше времени? Все дело в дофамине.В глубине вашего мозга, в
Источник: https://med.wikireading.ru/5488